Electrófilo y nucleófilo
Electrófilo y nucleófilo son los dos conceptos importantes en química orgánica que ayudan a describir las reacciones químicas entre los aceptores de electrones y los donantes. Estos dos términos fueron introducidos en 1933 por Christopher Kelk Ingold y sirvieron como sustitutos de los términos cationoid y anionoid que se introdujeron en 1925 por A.J. Lapworth
Desde entonces, se realizaron amplios estudios para comprender las diferencias entre electrófilo y nucleófilo. Este artículo desmitifica la diferencia entre estos dos conceptos. En pocas palabras, un nucleófilo es un donante de electrones, mientras que un electrófilo es un aceptor de electrones.
¿Qué es un electrófilo?
Para desglosar el término, la palabra "electro" proviene de los electrones y la palabra latina "phile" se refiere a "amar". En términos simples, significa amantes de los electrones. Es un reactivo que se caracteriza por una baja densidad de electrones en su cáscara de cenefa y, por lo tanto, reacciona con una molécula de alta densidad, ion o átomo para formar un enlace covalente. El ión hidrógeno en los ácidos y el carburo de metilo son ejemplos de sustancias electrofílicas. Son deficientes en electrones.
Un electrófilo se detecta fácilmente por una carga positiva o neutra con orbitales vacíos (que no cumplen la regla del octeto). Los electrones se mueven desde un área de alta densidad a la de baja densidad y, a diferencia de las cargas, se atraen entre sí. Esta teoría explica la atracción de electrones por los átomos electrófilos, moléculas o iones deficientes en electrones. Por definición, un electrófilo se denomina indistintamente ácido de Lewis, ya que acepta electrones de acuerdo con la definición del ácido.
La reacción y los compuestos a continuación muestran los ejemplos de electrófilos:

En esta reacción, el ion hidróxido reacciona con el cloruro de hidrógeno; Así, un ácido reacciona con una base. Como lo indica la flecha, el átomo de oxígeno más electronegativo dona electrones al átomo de hidrógeno deficiente en electrones. Comparte un par solitario con el átomo de hidrógeno que tiene una carga positiva en el cloruro de hidrógeno compuesto porque es más electronegativo que el hidrógeno. Esta reacción es un elemento fundamental de muchas reacciones de química orgánica, en particular las reacciones con ácidos de Lewis y bases de Lewis. Otros ejemplos se muestran en la siguiente imagen:
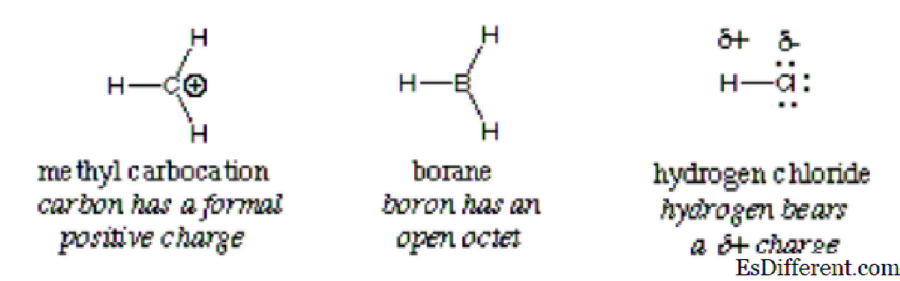
En general, un electrófilo se identifica por una carga positiva parcial como en cloruro de hidrógeno, una carga positiva formal como en carbocation de metilo o orbitales vacantes. Moléculas neutrales polarizadas tales como haluros de acilo, compuestos carbonílicos y haluros de alquilo son ejemplos típicos de electrófilos.
Importante: El ion hidronio, aunque tiene una carga positiva, no califica para ser clasificado como un electrófilo debido a los orbitales vacíos completos en su capa externa. Produce hidrógeno y agua. Lo mismo se aplica al ion amonio; no tiene orbitales vacantes que puedan atraer electrones. Como resultado, no es un electrófilo.
¿Qué es un nucleófilo?
El término se divide en la palabra "nucleo" que se refiere al núcleo y la palabra latina "phile" que significa amar. Simplemente significa núcleo amoroso. Los nucleófilos son ricos en electrones y, por lo tanto, donan pares de electrones a los electrófilos para formar enlaces covalentes en las reacciones químicas. Estas sustancias se notan mejor con pares solitarios, enlaces pi y cargas negativas. Los iones amoníaco, yoduro e hidróxido son ejemplos de sustancias nucleófilas.
Por definición, un nucleófilo se llama indistintamente la base de Lewis porque todos donan electrones y aceptan protones. La siguiente imagen muestra los ejemplos de nucleófilos:

El centro nucleofílico en un compuesto se detecta con el átomo más electronegativo. Considere el amoníaco NH3; El nitrógeno es más electronegativo y, por tanto, atrae electrones al centro. El compuesto tiene una alta densidad de electrones y, al reaccionar con un electrófilo, digamos agua, dona electrones. H2O puede actuar tanto como el electrófilo como el nucleófilo dependiendo del compuesto o molécula con el que reacciona.
Considere la siguiente imagen:
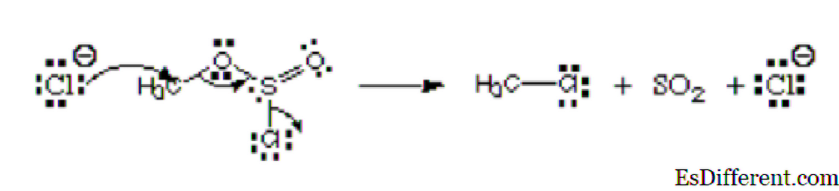
En la imagen, el primer átomo, el ion cloruro está donando su par solitario al carbono para formar un enlace covalente. Tiene la carga negativa y dona electrones, por lo que es considerado como el nucleófilo. Ese átomo de cloro que está dejando el éster de clorosulfito se denomina grupo saliente. No es un electrófilo o un nucleófilo.
Diferencia clave entre electrófilo y nucleófilo.
Definición de electrófilo y nucleófilo.
Un electrófilo es un ácido de Lewis que acepta electrones de un átomo, ion o molécula rico en electrones. Al aceptar los electrones, forma un enlace covalente. Este reactivo a menudo se identifica por una carga positiva parcial, una carga positiva formal o un átomo, ion o molécula neutra que no cumple la regla del octeto. Un nucleófilo, por otro lado, es un átomo, ion o molécula que tiene una alta densidad de electrones. Dona un par solitario al electrófilo para formar un enlace covalente. Se identifica por cargas positivas y electrones libres en su orbital.
Reacciones químicas de electrófilos y nucleófilos.
Un nucleófilo está involucrado en la sustitución y adición nucleófila, mientras que un electrófilo está involucrado en una sustitución y adición electrófila.
Identidad de carga en electrófilo y nucleófilo.
Un electrófilo puede tener una carga neutra o positiva, mientras que el nucleófilo puede tener una carga neutra o negativa.Un electrófilo acepta electrones, por lo que se conoce como el ácido de Lewis, mientras que un nucleófilo dona electrones, por lo que se conoce como la base de Lewis
Electrófilo Versos Nucleófilo: Cuadro de comparación

Resumen de versos electrófilos nucleófilos
- Un electrófilo es un átomo, molécula o ion deficiente en electrones, mientras que el nucleófilo es un átomo, molécula o ion rico en electrones.
- Un electrófilo puede tener carga positiva o neutra, mientras que el nucleófilo puede tener carga negativa o neutra
- Un electrófilo se llama el ácido de Lewis y el nucleófilo se llama la base de Lewis
- Un electrófilo acepta electrones y dona protones, mientras que un nucleófilo dona electrones y acepta protones.




