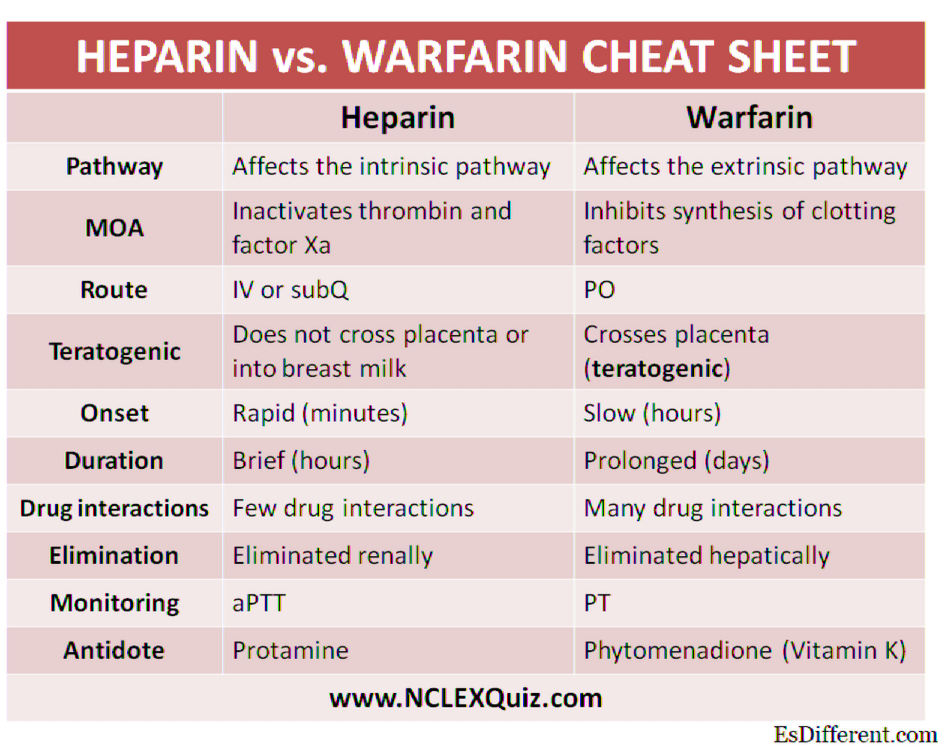
Ácido de Lewis y Base
Lewis Acid vs Base
Los ácidos y las bases son muy diferentes entre sí. Existen diferentes definiciones para ácidos y bases, pero el ácido de Lewis se refiere específicamente a la definición de un ácido que fue publicada en 1923 por Gilbert N. Lewis. En términos generales, se considera que el ácido de Lewis es un aceptor de pares de electrones, mientras que la base de Lewis se considera donante de pares de electrones.
Ácido de Lewis
El ácido de Lewis es una sustancia ácida que acepta un solo par o un solo par de electrones de alguna otra molécula para completar su propio átomo de grupo estable. Por ejemplo, H + puede aceptar un par de electrones para completar su grupo estable, por lo que es un ácido de Lewis porque H + requiere 2 electrones.
Otra forma de definir el ácido de Lewis, que ha sido aprobada por IUPAC es reconociendo que el ácido de Lewis es una entidad molecular que acepta un par de electrones, y por lo tanto reacciona con la base de Lewis para formar un aducto de Lewis. La reacción que tiene lugar entre el ácido de Lewis y la base de Lewis es que los ácidos aceptan el par de electrones, mientras que la base de Lewis los dona. El criterio principal detrás de la reacción es la producción de un "aducto" y no una reacción de desplazamiento.
El ácido de Lewis está restringido clásicamente a las especies que tienen un orbital p vacío y se denominan especies planares trigonales, por ejemplo BR3. Aquí R puede ser haluro o sustituyente orgánico.
Base de Lewis
La base de Lewis se puede definir como una especie o como una sustancia básica que dona un par de electrones a los ácidos de Lewis para formar un aducto de Lewis. Veamos el ejemplo de NH3 y OH-. Ambas son bases de Lewis porque pueden donar un par de electrones a los ácidos de Lewis.
NH3 le da un par de electrones solitario a Me3B en una reacción química y forma Me3BNH3, que es un aducto de Lewis. Me3B es un ácido de Lewis que acepta un par de electrones de NH3.
Hay algunos compuestos que actúan como ácidos de Lewis y bases de Lewis. Estas especies tienen la capacidad de aceptar un par de electrones o donar un par de electrones. Cuando aceptan un par de electrones o un par de electrones solitarios, actúan como ácido de Lewis. Cuando donan un par de electrones solitarios, actúan como base de Lewis; Por ejemplo, agua y H2O. Estos compuestos actúan como el ácido de Lewis o la base de Lewis dependiendo de la reacción química que tenga lugar.
Resumen
- El ácido de Lewis es una sustancia ácida que acepta un solo par o un solo par de electrones de alguna otra molécula para completar su propio grupo estable de átomos (por ejemplo, H +). El ácido de Lewis está restringido clásicamente a cualquier especie que tenga un orbital p vacío y se denomina especie planar trigonal. La base de Lewis puede definirse como una especie o sustancia básica que dona un par de electrones a los ácidos de Lewis para formar un aducto de Lewis.